Consigue 5 días de prueba gratuita registrándote ahora
En nuestro e-book gratuito, encontrarás estrategias probadas que ayudarán a tu hijo a mejorar sus hábitos de estudio. ¡Transforma su manera de estudiar hoy mismo!

Resueltoos.com Física y química
25-03-2025
Las leyes de los gases describen el comportamiento de los gases bajo diversas condiciones. Estas leyes proporcionan un marco teórico para comprender cómo los gases responden a cambios de temperatura, presión, volumen y cantidad de sustancia. Son cuatro leyes: la ley de Boyle-Mariotte, la ley de Gay-Lussac, la ley de Charles y la ley de Avogadro.
Esta ley establece que volúmenes iguales de diferentes gases, a la misma temperatura y presión, contienen el mismo número de partículas (moles). Esto implica que la cantidad de sustancia de un gas está directamente relacionada con su volumen. La ecuación que representa esta ley es: V / n = k
Donde “V” es el volumen, “n” es la cantidad de sustancia y “k” es una constante.
La ley de Boyle-Mariotte establece que, a temperatura constante, el producto de la presión y el volumen de una cantidad fija de gas es constante. En otras palabras, si aumentas la presión de un gas, su volumen disminuirá, y si disminuyes la presión, su volumen aumentará. La relación matemática que representa esta ley es: P₁ ∙ V₁ = P₂ ∙ V₂
Donde “P₁” y “V₁” son la presión y volumen iniciales, y “P₂” y “V₂” son la presión y volumen finales. Esto se puede comprobar fácilmente con un globo: al apretarlo se reduce su volumen, provocando que la presión en su interior aumente y se vaya poniendo cada vez más duro.
La ley de Charles establece que, a presión constante, el volumen de una cantidad fija de gas es directamente proporcional a su temperatura en Kelvin. En otras palabras, cuando aumenta la temperatura, el volumen del gas también aumenta, y cuando disminuye la temperatura, el volumen disminuye. Matemáticamente, se expresa como: V₁ / T₁ = V₂ / T₂
Donde “V₁” y “T₁” son el volumen y la temperatura iniciales y “V₂” y “T₂” son el volumen y la temperatura finales. Un claro ejemplo en el que se demuestra esta ley es al acercar un globo a una fuente de calor: al aumentar su temperatura, el globo crece porque se expande el aire que hay dentro, manteniendo la presión constante.
La Ley de Gay-Lussac establece que, a volumen y cantidad de sustancia constantes, la presión de un gas es directamente proporcional a su temperatura en Kelvin (K). En otras palabras, si aumentas la temperatura de un gas a volumen constante, su presión también aumentará, y si disminuyes la temperatura, su presión disminuirá. Matemáticamente, la ley se puede expresar como: P₁ / T₁ = P₂ / T₂
Donde “P₁” y “T₁” son la presión y temperatura iniciales, y “P₂” y “T₂” son la presión y temperatura finales. Volviendo al ejemplo del globo: si se calienta un globo sin dejar que se expanda, su presión irá aumentando hasta que, eventualmente, explote.
La primera de las leyes relacionadas con el comportamiento de los gases que se identificó fue la Ley de Boyle-Mariotte en el siglo XVII. Se llamada así debido a que fue independientemente descubierta por dos científicos: Robert Boyle, un influyente científico y filósofo irlandés que observó que, a una temperatura constante, la presión y el volumen de un gas se relacionaban de manera inversa; y Edme Mariotte, un físico y sacerdote francés que contribuyó considerablemente a la comprensión de esta relación.
Posteriormente, en el siglo XVIII, el matemático francés Jacques Charles realizó investigaciones pioneras en el campo de la física y la aerostática. En sus experimentos con globos de aire caliente, Charles observó que, a presión constante, el volumen de un gas aumentaba de manera proporcional a la temperatura medida en Kelvin. Sin embargo, Charles no llegó a publicar estos resultados, y fue en 1802 cuando Gay-Lussac publicó por primera vez la ley que hoy en día se conoce como “Ley de Charles”, pues, aunque no la publicase, fue el primero en desarrollarla. Además, a Gay-Lussac se le atribuye otro descubrimiento de gran importancia: la ley de Gay-Lussac, postulada también en el siglo XVIII.
Finalmente, durante el siglo XIX, Amedeo Avogadro realizó avances revolucionarios en la teoría molecular, postulando la ley de Avogadro, que fue una contribución fundamental para el entendimiento de la estequiometría y la teoría atómica. A pesar de que su propuesta fue inicialmente recibida con escepticismo, la idea de que los gases contenían un número fijo de partículas se convirtió en una de las bases de la química moderna.
En primer lugar, una ecuación de estado es una expresión que relaciona las variables de estado que describen un sistema en equilibrio termodinámico, esto es, cuando las variables de estado no varían a lo largo del tiempo.
Cuando el sistema a tratar es un gas sin interacción intermolecular y cuyas moléculas no tienen volumen, la ecuación de estado que describe este sistema se llama ecuación de estado de un gas ideal. Esta ecuación es el resultado de la combinación de las leyes de los gases ideales, a saber: la ley de Boyle-Mariotte, la ley de Gay-Lussac, la ley de Charles y la ley de Avogadro.
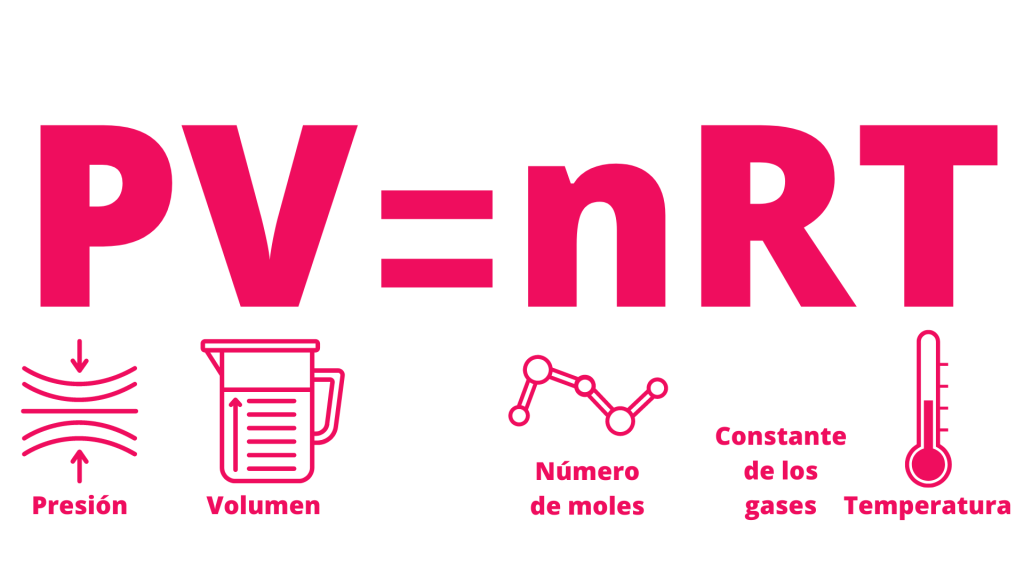
La ecuación de los gases ideales se expresa como: P*V = n*R*T
Donde “P” es la presión del gas, “V” es el volumen del gas, “n” es la cantidad de sustancia (medida en moles), “R” es la constante de los gases ideales y “T” es la temperatura del gas.
La constante de los gases ideales toma diversos valores en función de las unidades utilizadas en el resto de la ecuación. Así, R = 8,314 J / mol * K = 0,08206 L * atm / mol * K.
La ecuación de los gases ideales funciona mejor a temperaturas y presiones moderadas, es decir, en condiciones en las que no haya desviaciones significativas del comportamiento ideal de los gases.
Cuando se estudia un gas real, las leyes de los gases ideales no se aplican con precisión en todas las condiciones. Dichas leyes asumen que los gases consisten en partículas puntuales que no tienen volumen y no interactúan entre sí. Sin embargo, en la realidad, las partículas de un gas real tienen volumen y pueden experimentar fuerzas de atracción o repulsión mutuas.
A bajas temperaturas y altas presiones, los gases reales tienden a desviarse significativamente del comportamiento ideal (comportamiento crítico). En estas condiciones, las fuerzas intermoleculares entre las partículas de gas se vuelven más significativas, lo que afecta el comportamiento del gas.
Algunas de las desviaciones más comunes al estudiar gases reales son:
Desviación del volumen: En condiciones de alta presión y densidad, los gases reales ocupan un volumen mayor que el predicho por la Ley de Boyle-Mariotte. Esto se debe a que las partículas de gas tienen volumen propio y ocupan espacio.
Atracción intermolecular: Las partículas de un gas real pueden experimentar fuerzas de atracción mutua, especialmente a bajas temperaturas. Esto conduce a que la presión sea menor de lo esperado a una temperatura y volumen dados, lo que se conoce como desviación negativa.
Repulsión intermolecular: A temperaturas más altas, las partículas de gas pueden experimentar fuerzas de repulsión mutua. Esto resulta en una presión mayor de lo esperado a una temperatura y volumen dados, lo que se conoce como desviación positiva.
Para describir con precisión el comportamiento de los gases en tales condiciones, se requieren ecuaciones de estado más complejas, que tienen en cuenta todas estas desviaciones sufridas por el gas.
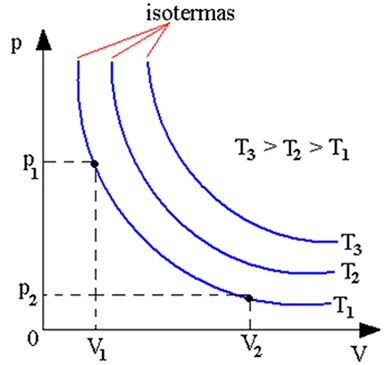
Una isoterma es una curva que representa gráficamente la relación entre la presión y el volumen de una sustancia (generalmente un gas) a una temperatura constante. Estas curvas son una parte fundamental del estudio del comportamiento de los gases en la termodinámica, ya que permiten visualizar cómo cambian las propiedades de un gas a diferentes presiones, manteniendo la temperatura constante. Los diagramas en los que se representan se denominan diagramas PV, y en ellos es posible representar las curvas obtenidas para diferentes temperaturas y así poder compararlas.
En el contexto de la termodinámica y el comportamiento de los gases, el estudio de las isotermas es esencial para comprender las relaciones entre presión, volumen y temperatura en sistemas gaseosos y proporciona información valiosa sobre cómo los gases responden a cambios en estas variables en condiciones de temperatura constante.
Las leyes de los gases tienen una amplia gama de aplicaciones en la vida cotidiana, la ciencia y la industria. Algunas de ellas son:
Industria química: En la industria química, las leyes de los gases son fundamentales para el diseño y la operación de reactores químicos, donde se controlan la presión y la temperatura para llevar a cabo reacciones específicas.
Investigación científica: La investigación en química y física se basa en gran medida en las leyes de los gases para comprender y predecir el comportamiento de sustancias gaseosas en diversos entornos.
Navegación aérea y espacial: La aerodinámica y la propulsión de aeronaves y cohetes dependen en gran medida del comportamiento de los gases bajo diferentes condiciones de presión y temperatura.
Meteorología: Las leyes de los gases se utilizan para entender el comportamiento de la atmósfera y predecir el clima. Los meteorólogos aplican principios termodinámicos para entender cómo los cambios de temperatura y presión influyen en la formación de sistemas climáticos y la predicción del tiempo.
Bienvenido a Resueltoos, la plataforma educativa que está transformando la forma en que los estudiantes abordan las matemáticas. Nuestra propuesta brinda ventajas destacadas tanto para padres como para estudiantes. Los padres confían en Resueltoos gracias a nuestros tutores virtuales altamente calificados y seguimiento personalizado, asegurando un éxito académico sólido para sus hijos. Los estudiantes se sienten atraídos por Resueltoos debido a su enfoque interactivo y divertido con juegos educativos que hacen que las matemáticas sean estimulantes. Cambiamos las matemáticas de un desafío a una habilidad esencial que abre las puertas hacia un futuro prometedor. ¡Únete hoy y prepárate para un emocionante viaje educativo!
2- ¿Quieres ser una gran científica?
3- Becas MEC
5- Puntos de corte con los ejes
6- ¿Cómo hacer factor de conversión?
Resueltoos
03-03-2025

Resueltoos.com
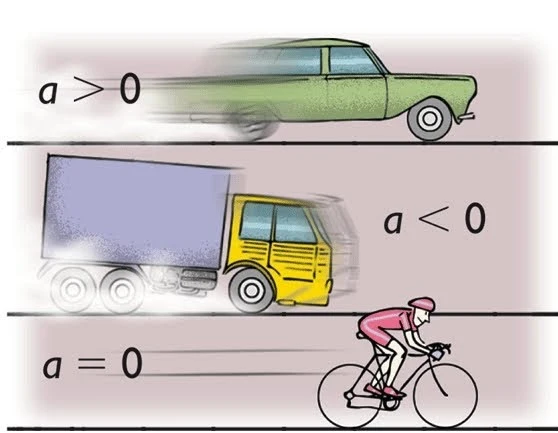
El movimiento circular se refiere a cualquier movimiento en el cual un objeto se mueve alrededor de un punto central en una trayectoria circular
Resueltoos
03-03-2025
Resueltoos.com
Un movimiento rectilineo es aquel en el que un objeto se mueve en linea recta, es decir, su trayectoria no presenta curvas ni cambios de direccion
Resueltoos
03-03-2025
Resueltoos.com
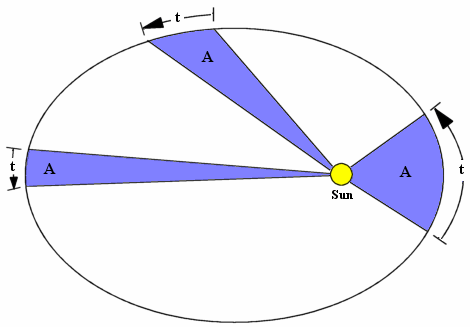
Las leyes de Kepler son tres principios empíricos que describen el movimiento de los planetas alrededor del Sol
Descubre nuestro e-book repleto de secretos para aprobar cada examen

Este sitio utiliza diferentes tipos de cookies. Puedes obtener detalles sobre todas las cookies utilizadas en este sitio haciendo clic a continuación en cada categoría de cookies. Las cookies estrictamente necesarias están siempre activadas, pero puedes gestionar tus preferencias dando tu consentimiento para el uso de cookies adicionales como se describe en nuestra Política de Cookies
Estas cookies son necesarias para que el sitio web funcione y no se pueden desactivar en nuestros sistemas. Por lo general, solo se configuran en respuesta a sus acciones realizadas al solicitar servicios, como establecer sus preferencias de privacidad, iniciar sesión o completar formularios. Puede configurar su navegador para bloquear o alertar sobre estas cookies, pero algunas áreas del sitio no funcionarán. Estas cookies no almacenan ninguna información de identificación personal.
Estas cookies nos permiten contar las visitas y fuentes de tráfico para poder evaluar el rendimiento de nuestro sitio y mejorarlo. Nos ayudan a saber qué páginas son las más o las menos visitadas, y cómo los visitantes navegan por el sitio. Toda la información que recogen estas cookies es agregada y, por lo tanto, es anónima. Si no permite utilizar estas cookies, no sabremos cuándo visitó nuestro sitio y no podremos evaluar si funcionó correctamente.
Estas cookies permiten recordar tus preferencias y configuraciones para mejorar tu experiencia en el sitio web. Gracias a ellas, el sitio puede recordar tus elecciones, como el idioma, región o configuraciones personalizadas. Si no permites estas cookies, algunas partes del sitio pueden no funcionar correctamente.
Estas cookies nos permiten gestionar, de la forma más eficaz posible, de los espacios publicitarios que, en su caso, se hayan incluido en el sitio web de Resueltoos.